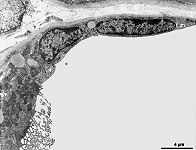
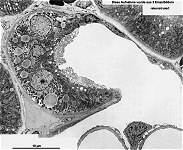
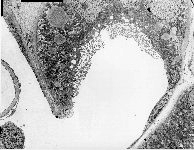
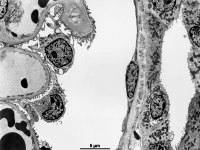
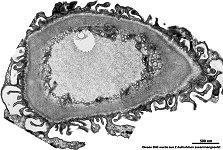
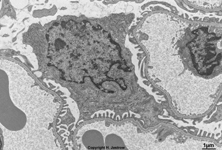
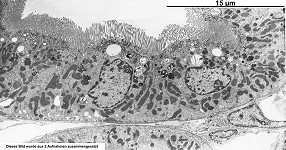
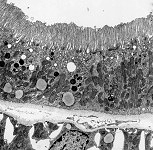
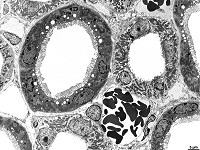
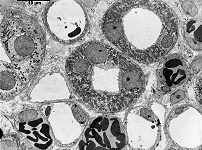
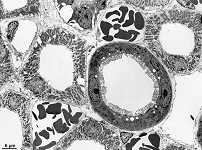
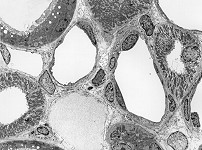
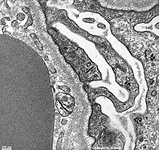
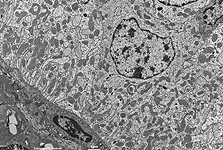
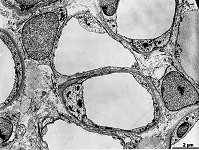
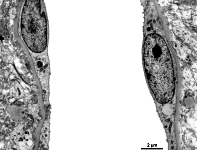
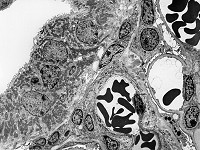
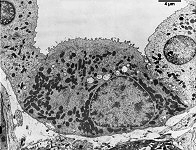
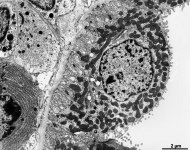
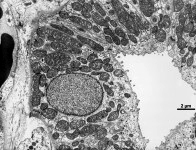
Abkürzungsliste
mikros-
kopische
Anatomie
Fachtermini
Deutsch
+ Englisch
erklärt

Alle publizierten Inhalte wurden eingehend geprüft, dennoch wird keine Haftung für Richtigkeit und Vollständigkeit der Angaben übernommen !

of this page
Editor:
Dr. med.
H.
Jastrow

Nutzungs-
bedingungen