| Abb.1 | Sinnesorgane, die Dauerimpulse an nachgeschaltete Neuronen weiterleiten besitzen spezielle Synapsen. Diese weisen vesikelumgebene elektronendichte Körperchen auf, die wegen ihres bandförmigen Aussehens im Englischen als Ribbons bezeichnet werden (Abb.2). Daher hat sich der Begriff "synaptic Ribbons" etabliert. Da es jedoch auch andere Formen der elektronendichten Zentren gibt, ist die Bezeichnung synaptische Körperchen sinnvoller. Solche synaptischen Körperchen kommen in der Netzhaut (Retina) in der äußeren und inneren plexiformen Schicht vor, sind aber auch in Haarzellen des Innenohrs und im Gleichgewichtsorgan anzutreffen. Neben den bandförmigen Strukturen gibt es kugelförmige, platten- und klumpenartige. Als Neurotransmitter findet sich in den Ribbonsynapsen Glutamat, welches mit sehr hoher Frequenz freigesetzt wird. | Abb.2
 |
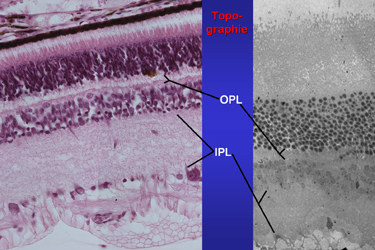
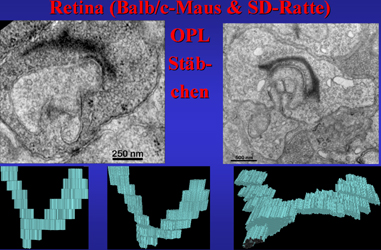
| Abb.3 | In zwei Schichten der Netzhaut kommen synaptische Körperchen
(SK) vor. Die größten und auch die höchste Dichte von SK
findet sich in der äußeren plexiformen Schicht, englisch outer
plexiform layer, hier und im Folgenden als OPL abgekürzt. In den hier
gelegenen Ribbonsynapsen werden Impulse von den Rezeptorzelle, Stäbchen
bzw. Zapfen, auf Bipolarzelldendrite übertragen. In der näher
zum Glaskörper gelegenen inneren plexiformen Schicht, englisch inner
plexiform layer, abgekürzt IPL werden an deutlich kleineren Synapsen
mit kleineren SK Impulse der verschiedenen Bipolarzellsorten an die Dendriten
der nachgeschalteten multipolaren Ganlienzellen weitergegeben (Abb.3).
In Abb.4 sehen wir Anschnitte synaptischer Körperchen im elektronenmikroskopischen Präparat der OPL der Retina einer Sprague-Dawley-Ratte. Die SK sind über feine Proteinbrücken an einer rinnenartigen, elektronendichten Struktur, der arciform Density an der präsynaptichen Membran von Stächenterminalen verankert. Postsynaptisch lassen sich helle mit größeren Vesikeln gefüllte Neuritenendigungen von Horizontalzellen erkennen, die hemmend auf die den Impuls der Synapsen weiterleitenden Bipolarzelldendriten wirken. Letztere sind vesikelarm, relativ klein und liegen meist weiter unten in dem synaptischen Komplex, der durch die Einstülpung der Bipolar- vor allem aber Horizontalzellfortsätze in die basalen Endigungen der Stäbchen entsteht. |
Abb.4
 |
| Abb.5 | Die präsynaptischen Körperchen sind
sehr elektronendicht und lassen bei genau senkrechten Anschnitt eine 5-Streifung
erkennen, die durch die regelmäßige Anordnung ihrer Hauptkomponente
dem Protein RIBEYE verursacht wird (Abb.5). Neben diesem finden
sich im bzw. direkt am elektronendichten Bereich neben Kalzium und noch
unbekannten Komponenten die aufgeführten Proteine. In der Region wo
das SK sich der Membran anlagert, ist das für seine Verankerung wichtige
Basson zu finden. Dort wo über feine Proteinarme Vesikel angedockt
sind, kommt Piccolo vor.
Bisher konnte die genaue Funktion der SK nicht sicher bewiesen werden. Abb.6 zeigt die wesentlichen postulierten Funktionen auf. Zum einen wird vermutet, sie befördern angedockte Vesikel zu den nahen aktiven Zonen, d.h. Bereichen, wo die Glutamat-haltigen Neurotransmittervesikel (NTV) mit der präsynaptischen Membran verschmelzen. Hierfür spricht der erbrachte Nachweis des Motorproteins KIF3a, einer Komponente des Kinesin 2. Zum anderen lassen die membrannah zurückgehaltenen NTV eine Funktion als Speicher für eine schnelle erneute freisetzung vermuten. Da Piccolo bei der Wiederauffüllung der Vesikel mit Glutamat eine Rolle spielt sind die SK sicher auch Orte der (Wieder)beladung der NTV. |
Abb.6
 |
| Abb.7 | Dunkelheit führt zu einer tonischen Entladung
der Rezeptorzellen, die Synapsen sind hochaktiv und schütten große
mengen an Glutamat aus. Die SK und auch die zugehörigen synaptischen
Komplexe erreichen maximale Größe. Es finden sich in Stäbchen
fast ausschließlich C- bis U-förmige SK. Licht führt zu
einer Hyperpolarisation und reduzierter Transmitter Freisetzung. Die Größe
von SK und Terminal reduziert sich, an membranabgewandten Bereichen zeigen
sich Verdickungen der SK und es treten kugelige und klumpige SK auf (Abb.7).
Abb.8 zeigt auf, welche Ziele ich bei der Untersuchung der SK verfolge. Neben einer quantitativen Erfassung synaptischer Körperchen bin ich an deren dreidimensionaler Rekonstruktion interessiert. Dabei ist sowohl der Vergleich unterschiedlicher Rezeptorzellen als auch zu Säugetierspezies interessant. Ferner möchte ich biochemische und physiologische Veränderungen mit denen der Morphologie von SK korrelieren um zu einem weiterreichenden Verständnis der Vorgänge an diesen Sinneszellsynapsen zu gelangen. |
Abb.8
 |
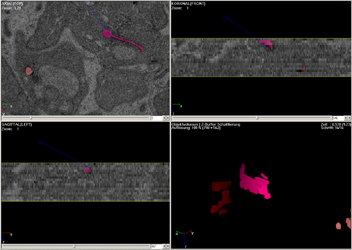
| Abb.9 | Abb.9 demonstriert die Methoden: zur Untersuchung
der SK werden elektronenmikroskopische Serienschnitte herangezogen. Die
verschiedenen Formen werden quantitativ erfaßt und an geeigneten
Synapsen dreidimensional rekonstruiert. Die gewonnenen Voxelobjekte lassen
sich mit geeigneter Software (Programmen der Firma ConVis
und Amira 3.1) in Form von Einzelansichten,
Stereobildern und Animationen visualisieren.
Die in Abb.10 gezeigten Originalschnitte sind Flachanschnitte in denen ein Großteil gesamter SK erkennbar ist. Die 3D-Rekonstruktionen verdeutlichen die U bis V-Form der relativ langen, dünnen Organellen. |
Abb.10
 |
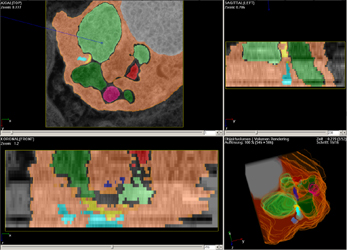
| Abb.11 | Mit Hilfe einer Rekonstruktionssoftware der Firma
ConVis
werden die Profile der Strukturen auf allen Schnitten einer Serie farbig
markiert und dabei entsprechenden Voxelobjekten zugewiesen (Abb.11).
Neben dem axial orientierten Originalschnitt sind rechts bzw. unten die
errechneten weiteren anatomishen Schnittebenen erkennbar. Links unten werden
die segmentierten SK dreidimensional dargestellt.
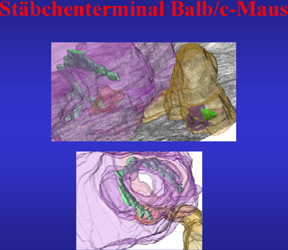
Aus der Folge der in Abb.12 gezeigten segmentierten Serienschnitte läßt sich eine Ribbonsynapse eines Stäbchens einer Balb/c-Maus rekonstruieren. Die Fortsätze unterschiedlicher Bipolar- bzw. Horizontalzellen sind mit nyancierten Farben markiert. |
Abb.12
 |
| Abb.13 | Abb.13 zeigt Ansichten aus
dem fertig segmentierten 3D-Datensatz und eine Rekonstruktion. Aufgrund
der in Vergleich zur X-Y-Auflösung durch die Schnittdicke bedingten
schlechten Z-Auflösung entstehen in den sagittalen und Koronalen Ansichten
Stufen.
Um das obere Stereobild in Abb.14 farbig dreidimensional zu sehen, muß man so schielen, daß die hellblauen Strukturen die das SK darstellen verschmelzen. Unten eine andere Art dreidimensionaler Darstellung. |
Abb.14
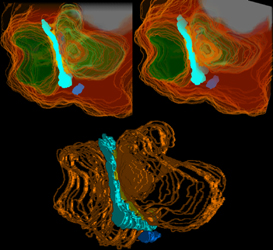 |
| Abb.15 - | Am besten lassen sich die Verhältnisse jedoch mit Hilfe von Animationen
veranschaulichen (Abb15; Anklicken startet die Animation). Das hellblaue
SK ist etwa C-förmig, ein dunkelblaues plattenartiges SK erscheint
in einem rücklaufenden Fortsatz des Stäbchens und ein weiteres
marineblaues ist eine klumpige Struktur die weiter von der synaptischen
Membran entfernt ist.
Die Software Amira 3.1 ermöglicht eine Glättung von Konturen, wodurch die rekonstruierten Gebilde wesentlich ästhetischer erscheinen, da dabei jedoch auch tatsächlich vorhandene Information verrechnet wird, wurde bei der Darstellung der in Abb.16 gelb markierten SK auf die Glättung verzichtet. Das Stäbchenterminal ist violett und wird links oben mit den SK gezeigt, in den folgenden Bildern werden sukzessive Bipolarzelldendriten eingeblendet. Danach in Hellblau Terminale von Horizontalzellen. Da im letzten Bild das Stäbchenterminal nicht visualisiert wird, sind die übrigen Strukturen deutlicher zu erkennen. |
Abb.16
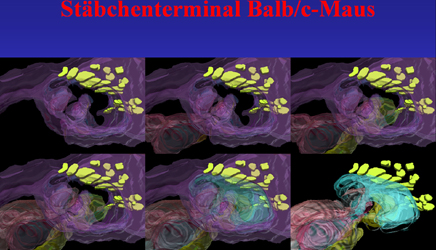 |
| Abb.17 - | In dem in Abb.17 gezeigten Stäbchenterminal
einer Ratte ist neben einem großen C-förmigen SK und ein paar
abgesplittertet erscheinenden weiteren SK ein Bipolarzelldendrit erkennbar.
Der Film verdeutlicht die Topographie der Strukturen die hier alle geglättetet
sind. Wenn Sie hier klicken können Sie eine Animation der unteren
rekonstruierten Synapse sehen.
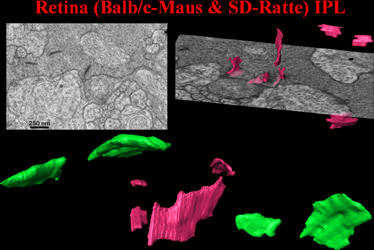
Die innere plexiforme Schicht (IPL) zeigt ein ganz anderes Bild von SK: die relativ kleinen SK erscheinen wie dünne gebogene Scherben (Abb.18). Die grünen stammen von einer anderen Stelle als die roten. |
Abb.18
 |
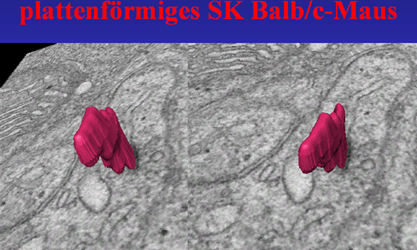
| Abb.19 - | Die in Abb.19 gezeigte Animation (Anklicken
zum Starten) zeigt 2 plattenförmige geglättete
SK in einem Bipolarzellfortsatz der IPL der Ratte. Interessanterweise findet
sich keine Synapse nahe den SK und diese verlaufen etwa parallel zur Membran
ohne sich dieser direkt anzunähern.
Das in Abb.20 gezeigte Stereobild ermöglicht eine tatsächlich dreidimensionale Sicht auf das kleine plattenförmige SK. |
Abb.20
 |
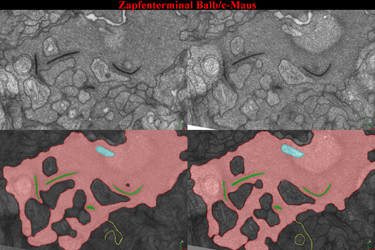
| Abb.21 | Abb.21 demonstriert zwei Serienschnitte
mit den zugehörigen segmentierten Bildern eines 3D Datensatzes eines
Zapfenterminals der Bald/c-Maus.
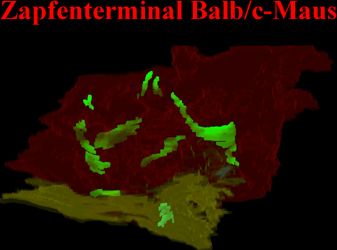
Anklicken der Abb.22 startet eine animierte Rekonstruktion synaptischer Körperchen in Zapfenzellen. Man erkennt, daß dies deutlich größer sind. Ferner kommen wesentlich mehr der Organellen in dem großen Terminal vor in das an verschiedenen Stellen, die hier nicht visualisiert sind Fortsätze eintreten um Synapsenkomplexe zu bilden. |
Abb.22 -
 |
| Abb.23 hier direkter Link zu der Internetseite | Neben der wissenschaftlichen Untersuchung der
Ribbonsynapsen beim Menschen bin ich auch an der Gewinnung von qualitativ
hochwertigem Bildmaterial für meinen elektronenmikroskopischen Atlas
im Internet interessiert (Abb.23).
Mit dem in Abb.24 gezeigten lachenden SK bedanke ich mich für Ihre Aufmerksamkeit. Mein Dank gilt ferner Frau Ilse von Graevenitz für die Anfertigung der Schnitte, Herrn Dirk B. Gustavus und Georg Kolios die im Rahmen ihrer Doktorarbeiten beim Segmentieren einiger der hier gezeigten Datensätze mitgearbeitet haben und Frau Dr. Isabella Spiwoks-Becker für die Bereitstellung des Materials und hilfreiche Diskussion. |
Abb.24
 |